近日,港交所IPO市场又接到另一家创新型生物科技企业冠科美博有限公司(下称“冠科美博”)的上市申请书,摩根士丹利、美银证券与华兴资本为其联席保荐人。
与国内本土创新型生物科技不同的是,冠科美博是由全球性的药物发现和开发公司中美冠科生物技术(跨国企业)经过分拆重组而来。现阶段,冠科美博主要专注于探索及开发可能与其他治疗方法结合的肿瘤疗法,以利用免疫系统和靶向特定分子信号通路来抑制癌症。
2015年5月21日,为了方便中美冠科生物技术进行分拆,冠科美博在开曼注册成立。同年12月31日,中美冠科生物技术分拆位于中国台湾的附属公司冠科药业,并将其注入到新成立的冠科美博。至此,冠科美博就成为冠科药业的母公司,并拥有包括APL-101(是一种新型的具有高度选择性的小分子c-Met抑制剂)在内的多项临床前项目的权力。
在冠科美博成立不久后,开始在美国、澳大利亚注册分公司,主要业务是从事研发肿瘤单药及联合疗法。而冠科美博进入中国市场则是在2018年。
2018年5月29日,冠科美博在杭州成立浙江冠科美博生物科技有限公司(下称“浙江冠科美博”),主要业务同样是从事研发肿瘤单药及联合疗法。
不同的是,为了更快的在中国市场站稳脚跟,冠科美博给浙江冠科美博配备了最先进的研发设备,并采用国际先进技术建造中国生产基地,以支持公司产品的临床前、临床研究和最终商业化供应。
成立至今,冠科美博共进行了三轮融资,累计共融资约2.34亿美元。其中,B轮融资中,B轮共融资约9,899.9万美元,由招银国际领投、奥博资本、佳辰资本、磐霖资本等机构跟投;C轮则共融资1.2425亿美元,由平安领投,燕创、启裕、亿创等机构跟投。三轮融资资金冠科美博均用于日常营运和业务拓展,核心产品及在研产品的研发,以及营运资金。
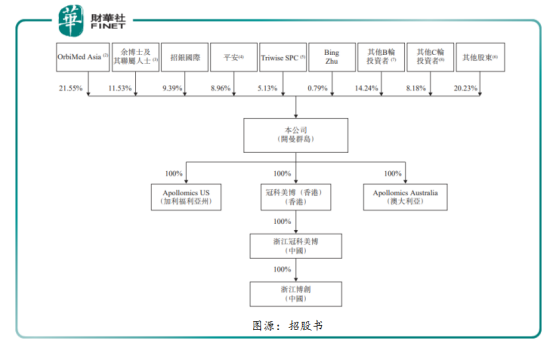
从上市前公司股权框架来看,奥博为冠科美博第一股东持有21.55%的股份,创始人、主席兼首席执行官余国良及联属人士持有11.53%的股份为第二大股东,第三及第四股东分别为招银国际及平安,分别持有为9.39%及8.96%的股份。
据了解,此次冠科美博拟赴港IPO,计划融资2-3亿美元。据招股书显示,上市筹资资金用途为核心产品的研发、商业化过程中开发、制造以注册为目的临床试验材料及工艺验证提供资金。同时,对其他研发管线候选药物的研发提供资金。
自2015年成立以来,冠科美博已建立一条由十种专注于肿瘤学的候选药物组成(跨12个项目)的管线,其中五种候选药物处于临床阶段。
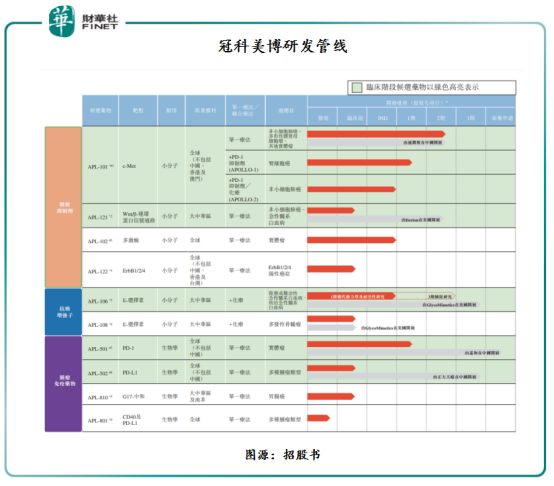
冠科美博现有研发管线可基于其作用机制分为三组,每组均包含处于不同开发阶段的候选药物。
第一组为“肿瘤抑制剂”,包含四种针对癌细胞中不同的不受控制生长信号通路的小分子抑制剂。
第二组为“抗癌增强子”,其可增强其他疗法的抗癌效果。该组包含两种针对一种细胞粘着受体的拮抗剂。
第三组为“肿瘤免疫药物”,其可利用人体的免疫系统对抗癌症。该组包含四种候选药物,包括针对癌细胞释放免疫应答自然制动器的单特异性及双特异性抗体,以及一种新型癌症疫苗。
在十种专注于肿瘤学的候选药物组合中,冠科美博核心产品APL-101商业化前景较为可期。
APL-101临床阶段候选药物之一,是一种针对多种肿瘤中靶向c-Met失调通路的新型、选择性小分子c-Met抑制剂。其为一种具有选择性且强效的c-Met受体激酶(于多种肿瘤类型中过度表达及╱或突变)的抑制剂。
目前,冠科美博将APL-101用作单药,已完成对美国晚期恶性肿瘤及非小细胞肺癌中c-Met失调受试者进行的1/2期试验(NCT03175224(即APL-101-01研究) ) 的1期部分。涉及c-Met失调的多个同期群的1/2期试验的2期部分目前正在进行中。
据招股书显示,冠科美博首要目标适应症为携带14号外显子跳跃突变的非小细胞肺癌c-Met抑制剂初治受试者的二、三线治疗。这主要驱动因素是c-Met抑制剂拥有不错的市场潜力。根据灼识咨询报告,2019年全球(中国除外)非小细胞肺癌发病人数为100万例,预计到2030年将扩增至130万例。其中,冠科美博深耕的美国市场,预计于2030年将达到约221,200例。
更值得关注的是,截至2020年12月31日,尚无c-Met 抑制剂于美国获批用于治疗多形性胶质母细胞瘤,且概无任何针对多形性胶质母细胞瘤的 c-Met抑制剂管线于美国食品药品监督管理局注册。
基于c-Met抑制剂的优势,冠科美博便利用联合试验,来提高单药疗效。据招股书书显示,冠科美博正在启动c-Met抑制剂联合试验 APOLLO-1。APOLLO-1是一项进行中的1/2期试验(NCT03655613),以评估APL-101及PD-1抑制剂在澳大利亚及新西兰实体瘤受试者中的联合疗效。该试验正处于剂量递增阶段。
除此之外,还有联合试用项目APOLLO-2。APOLLO-2为一项在美国进行的APL-101联合标准疗法(帕博利珠单抗或培美曲塞╱铂类化疗)对美国初治转移性14号外显子跳跃突变的非小细胞肺癌受试者进行的1/2期试验。据招股书显示,冠科美博已于2020年9月向美国食品药品监督管理局提交了APOLLO-2的临床试验方案,并于2021年1月及2月提交了更新的临床试验方案。
据冠科美博招股书数显示,倘若于2024年初前,获相关监管机构授出上市批准,则计划届时于美国及欧洲开始首次商业化推出APL-101。
虽着核心产品APL-101不管单药还是联合用药都有着不俗市场空间,但同样存在不小的挑战及不确定性。
据招股书显示,就APL-101有关的肝毒性研究结果相关的近期临床试验开发与美国食品药品监督管理局通讯,而且冠科美博已采取相应的缓解措施,包括向美国食品药品监督管理局提交APL-101-01研究的经更新方案,以及要求APL-101-01研究的相关研究者立即于开展研究时进行若干调整,并监控APL-101-01研究2期中受试者的安全情况。
截至2021年2月8日(美国东部标准时间),在APL-101- 01研究2期部分给药的患者中,合计38名患者使用APL-101,就有六名患者出现APL-101相关天冬氨酸转氨酶、谷丙转氨酶或总胆红素升高达到3级或更高级别的情况,其中三名患者出现严重不良事件及三名患者出现不良事件。
就38名患者而言,终止边界为十名患者。倘若相关肝损伤事件的数量达到终止边界,冠科美博招募将终止且安全审查委员会将开会,以进一步评估任何适当的步骤。如此一来,这势必会给APL-101临床试验进度带来一定影响。
从过往临床试验来看,冠科美博有终止试验的案例。据招股书显示,由于联合疗法在有关适应症中不耐受,曾终止了APOLLO-1(即APL-501联合APL-101)试验的肝细胞癌组。
综上所述,即使候选药物拥有可观的前景及市场空间,但在候选药物未进行商业化销售之前,候选药物可安全及有效地用于各项目标适应症的结果,都有可能给公司商业化带来变数。
文:从心
1998-2025深圳市财华智库信息技术有限公司 版权所有
经营许可证编号:粤B2-20190408
粤ICP备12006556号